La peculiar biología del virus de la diarrea viral bovina (BVD) con el nacimiento de animales persistentemente infectados (PI) tras la infección en el útero, además de la infección transitoria de animales, exige que se tenga en cuenta la transmisión vertical y horizontal. Inicialmente, se analizó a todos los animales para detectar la presencia de PIs durante el primer año, a lo que siguieron análisis para detectar la presencia del virus en todos los terneros recién nacidos durante los cuatro años siguientes. De este modo, la prevalencia de terneros nacidos PI disminuyó sustancialmente de alrededor del 1,4% a <0,02%, lo que permitió abandonar las pruebas amplias para detectar el virus y pasar a una vigilancia serológica económicamente más favorable, prohibiéndose la vacunación. A finales de 2020, más del 99,5% de todas las explotaciones de ganado vacuno en Suiza estaban libres del VDVB, pero la eliminación de los últimos animales PI restantes resultó ser un hueso más duro de roer.
El virus y sus estrategias de infección
Los virus utilizan dos estrategias diferentes para permanecer en su población de huéspedes. Por un lado, el denominado enfoque "golpear & huir" indica que un hospedador primario se infecta sólo durante un corto periodo de tiempo, lo que requiere que el virus se transfiera rápidamente al siguiente hospedador. El virus de la rabia, que acaba matando al huésped primario infectado transitoriamente, y el virus de la gripe o el virus SARS-CoV-2, actualmente pandémico, dejan tras de sí un huésped al menos parcialmente inmune, y son ejemplos típicos de este enfoque. Por el contrario, la estrategia "infectar y persistir" (también llamada "golpear y permanecer") indica que el huésped está infectado de forma crónica o incluso de por vida, lo que en la mayoría de los casos requiere que el virus haya evolucionado medios sofisticados para evadir el sistema inmunitario del huésped (19, 20). Ejemplos bien conocidos de esta última estrategia son el VHC, el VIH o los herpesvirus.
El éxito de la supervivencia mundial del virus del BVD y otros pestivirus de rumiantes en su población hospedadora se basa en que aplican ambas estrategias, es decir, infecciones transitorias y persistentes.
La infección persistente se establece a partir de la infección fetal de vacas gestantes dentro de los primeros ~150 días de gestación con un biotipo no citopático (no letal) del BVD. Este momento temprano de la infección fetal antes del desarrollo de la inmunidad adaptativa, la capacidad del virus para bloquear la activación de la respuesta antiviral innata del hospedador, y la placentación epiteliochorial distintiva de los rumiantes que no permite la transferencia de anticuerpos maternos, conduce a la inmunotolerancia específica al virus y al nacimiento de un ternero persistentemente infectado (PI). Pueden parecer sanos, pero los síntomas respiratorios son más frecuentes en los animales jóvenes, mientras que los síntomas entéricos se observan con más frecuencia en los animales de más edad. En contraste con otras infecciones víricas persistentes, los animales PI no producen ni una respuesta inmune celular ni humoral contra la cepa vírica persistente y permanecen, por tanto, con anticuerpos negativos. Los animales PI siguen excretando grandes cantidades de virus de por vida y siguen siendo un hilo conductor constante para propagar el virus a animales sanos y representan el reservorio más importante que mantiene el virus en su población huésped.
La infección aguda de ganado vacuno adulto y sano con cualquiera de los biotipos del virus de la diarrea viral bovina provoca una viremia transitoria que suele ser asintomática o ir acompañada únicamente de diarrea leve o síntomas respiratorios, pero en raras ocasiones puede observarse trombocitopenia grave y hemorragia. Durante una infección aguda que dura ~2 semanas, el virus puede encontrarse en diversas secreciones y, por tanto, transmitirse a nuevos huéspedes susceptibles. Sin embargo, las infecciones transitorias por sí solas no son suficientes para mantener la circulación del virus durante largos periodos en su hospedador, con una posible excepción en grandes rebaños. No obstante, las infecciones transitorias bien podrían contribuir a las transmisiones locales sorteando la ausencia temporal de animales susceptibles y preñados, conduciendo finalmente a la infección de animales sanos y preñados, y a la reaparición de nuevos animales PI que son necesarios para la supervivencia a largo plazo de este virus en su población hospedadora.
Por lo tanto, El BVD en rumiantes está utilizando con éxito ambas estrategias de infección, es decir, infectar y persistir, así como golpear y huir, lo que tiene consecuencias directas en la aplicación de programas de control de la BVD, por ejemplo, la interpretación de las pruebas de antígenos y anticuerpos, o el lapso de tiempo que se tiene en cuenta en el rastreo de contactos.
El esquema suizo de erradicación
Toda la cabaña bovina de Suiza cuenta con unos 1,5-1,6 millones de animales, y cada año nacen entre 600.000 y 700.000 terneros. Los costes de la enfermedad debidos al BVD se estimaron entre 9 y 16 millones de euros al año, dependiendo del modelo aplicado y de si se incluían las pérdidas por animales infectados transitoriamente (IT). Esto llevó a las distintas asociaciones de ganaderos de Suiza a exigir la erradicación del BVD de la población bovina suiza. El programa suizo de control de la BVD comenzó en 2008 y se basa en la detección y eliminación de cada animal PI. El programa de control se dividió en tres fases:
- la fase inicial, en la que toda la población bovina debía someterse a tomas de muestras de cartílago en las orejas para realizar pruebas de antígenos, excepto las explotaciones de engorde puras, en las que los animales sólo salen depara el sacrificio,
- la fase de terneros, con pruebas de antígenos de todos los terneros recién nacidos,
- la fase de vigilancia, con pruebas serológicas de los rebaños libres de la enfermedad mediante leche a granel en los rebaños lecheros y muestras de sangre en los rebaños de vacuno de carne.
Esta última fase supuso la prohibición de la vacunación desde el principio. Se impusieron dos importantes principios básicos adicionales que se consideraron innegociables en todo el plan de control: En primer lugar, los movimientos de ganado no debían verse obstaculizados, o sólo durante un breve periodo de tiempo, por pruebas o restricciones. Esto también exigía el inicio simultáneo del programa nacional de control en todos los cantones. En segundo lugar, la definición de caso de un rebaño infectado debería basarse exclusivamente en la detección de un animal PI. Se espera que estas directrices limiten la carga económica que suponen las medidas de erradicación para las explotaciones individuales y, al mismo tiempo, aumenten el compromiso de los ganaderos para participar activamente en el programa. Retrospectivamente, cabría preguntarse desde un punto de vista epidemiológico si la decisión de no regular los movimientos de animales podría haber reducido la eficacia del programa de control. Así, se demostró que el movimiento de animales tenía una gran importancia para el control de la BVD en Suiza, y la regulación del movimiento de animales se ha descrito como una medida importante en el exitoso programa de control de Suecia.
2008: La fase inicial. Inicio de las pruebas virológicas
En 2008, se realizó un cribado de toda la cabaña bovina para detectar la presencia de animales PI, empezando en primavera con los animales que pasarán el verano en los pastos alpinos comunes. En este cribado inicial, el 0,8% de todos los bovinos fueron positivos al virus, y el 20,0% de todos los rebaños tenían al menos un animal positivo al virus. Posteriormente, todos los terneros recién nacidos fueron sometidos a pruebas de detección del BVD, bien mediante ELISA de antígenos o mediante RT-PCR utilizando muescas en las orejas, tomadas en su mayoría por el ganadero, o muestras de sangre. Desde el otoño de 2009, se exigieron investigaciones epidemiológicas que incluían el rastreo de contactos para cada animal PI identificado. El objetivo era reducir la prevalencia de animales infectados por el virus de la peste bovina a cero en un plazo de tres años para poder pasar a una vigilancia basada en la serología. Entre 2008 y 2012, la proporción de todos los terneros recién nacidos que eran PI cayó del 1,4% a <0,02% (59). En 2011, se volvió a evaluar la situación y se llegó a la conclusión de que el número de rebaños infectados seguía siendo demasiado elevado para iniciar la vigilancia mediante serología. Concomitantemente, los servicios veterinarios regionales se mostraron bastante reacios a abandonar el sencillo y probado esquema de pruebas de antígenos y pasar a la más complicada vigilancia serológica. Además, debido a la elevada seroprevalencia antes del inicio del programa de erradicación, se supuso que la proporción de muestras de leche de tanque positivas seguía siendo demasiado alta para realizar las pruebas correspondientes en los rebaños lecheros. Además, 55 animales PI que inicialmente resultaron negativos ("falsos negativos") fueron detectados mediante investigaciones epidemiológicas hasta finales de 2010, lo que implicaba aún más que era necesario colmar algunas lagunas en el esquema de control. Así pues, la transición de las pruebas virológicas a las serológicas se pospuso hasta 2012.
2012: La fase de los terneros. Transición a la vigilancia por serología
En 2012, se aplicaron en paralelo los dos sistemas de pruebas, es decir, las pruebas de detección del virus en todos los animales recién nacidos y las pruebas de detección de anticuerpos en los rebaños, para adquirir más experiencia y aumentar la confianza en la vigilancia serológica manteniendo un alto compromiso de todas las partes interesadas con el programa de control. Los rebaños lecheros se vigilaron mediante la serología de la leche a granel, y los no lecheros mediante muestras de sangre de un grupo de bovinos jóvenes. Los resultados de la prueba ELISA para leche a granel se clasificaron en 4 clases en función de su nivel de anticuerpos. Estas definiciones limitaron el número de rebaños con un resultado positivo (no negativo) que debían ser examinados mediante pruebas al azar. Mientras que los rebaños lecheros se examinaban dos veces al año, los rebaños restantes solo se controlaban cada tres años, ya que el muestreo y el análisis mediante pruebas al azar eran los mayores generadores de costes en la vigilancia serológica. Los datos de 2012 indicaban un menor riesgo de nacimientos por IP en el sector no lácteo en comparación con los rebaños lecheros, lo que justificaba retrospectivamente estos diferentes esquemas de pruebas. Los datos obtenidos en este "año de transición" indicaron que el nivel de seropositividad parecía ser lo suficientemente bajo, y debido a los altos costes asociados con las pruebas virológicas de todos los terneros, el cambio a la vigilancia serológica exclusiva se implementó en 2013.
2013-2018: Fase de vigilancia de anticuerpos
Todos los rebaños lecheros deben someterse a pruebas dos veces al año y todos los rebaños no lecheros una vez cada tres años. La prueba por muestreo debe incluir al menos cinco animales no <6 meses de edad y nacidos después de septiembre de 2009, o el 10% de la población en rebaños más grandes. Los requisitos adicionales para que los animales fueran incluidos en una prueba por muestreo eran
- que hubieran nacido al menos 1 mes después de la eliminación del último animal con IP del rebañom
- Que hubieran permanecido en el rebaño a analizar durante al menos 6 meses.
- Que no hubieran formado parte de un rebaño que contuviera un animal con IP durante y después de su estancia en ese rebaño
- Que los animales no hubieran sido seropositivos anteriormente.
También se realizaron pruebas puntuales en rebaños lecheros con un resultado de leche a granel "no negativo".El resultado fue que sólo se tomaron muestras en el 80% de los rebaños no lecheros al menos una vez en 3 años. Además, estos rebaños no fueron sometidos a pruebas de manera uniforme en este periodo, sino que la mayoría de ellos fueron sometidos a pruebas en el último año. Por lo tanto, el aumento en el recuento de casos 2013-2015 podría atribuirse, al menos en parte, al aumento de las pruebas en los rebaños no lecheros hacia el final de este período de 3 años.
En 2015, la frecuencia de muestreo de los rebaños lecheros se redujo a una vez al año. Esto dio lugar a un periodo prolongado sin pruebas en las explotaciones lecheras, desde el otoño de 2015 hasta el otoño de 2016. En el momento en que se tomó esta decisión, la opinión predominante era que el virus casi se había erradicado, por lo que la vigilancia podía reducirse considerablemente. Por desgracia, esto resultó no ser así en absoluto. El plan de erradicación sufrió un duro revés, y el número anual de casos se duplicó de 2015 a 2017. Como consecuencia de ello, en otoño de 2015 se incrementaron las investigaciones epidemiológicas, y en 2017 se intensificó la vigilancia con la realización de pruebas a los rebaños lecheros dos veces al año y, en 2019, las pruebas a todos los demás rebaños se incrementaron a una vez al año. A pesar de que el brote de 2017 afectó principalmente a los rebaños lecheros, lo más probable es que el fuerte aumento regional de casos de ese año estuviera relacionado con un grupo de rebaños muy interconectados y con el incumplimiento individual del programa de control. Sin embargo, es seguro asumir que la reducción de la vigilancia ciertamente contribuyó al aumento constante de la propagación del BVD en los años 2012-2017. No fue hasta 2019 cuando se hizo evidente otra consecuencia del brote de 2017: la tasa de seropositividad de las muestras de leche a granel aumentó considerablemente, ya que las novillas de reposición seropositivas de los rebaños afectados por el brote anterior a menudo se trasladaban a otros rebaños donde entraban en lactación. Esto condujo de nuevo a un aumento del número de muestras de leche a granel positivas y, en consecuencia, del número de pruebas al azar necesarias, lo que incrementó aún más los costes y la carga de trabajo de los servicios veterinarios regionales.
Los servicios veterinarios regionales responsables de la toma de muestras in situ estimaron que la carga de trabajo sería demasiado elevada si se tomaran muestras anuales de todos los rebaños no lecheros. Para superar esta limitación, en 2016 se inició el proyecto RiBeS ("Rinderbeprobung am Schlachthof"; muestreo del ganado en el matadero) para tomar muestras de sangre para la vigilancia del ganado durante la inspección de la carne en grandes mataderos, como se propuso posteriormente de forma similar en Japón. El muestreo en los mataderos alcanzó el nivel esperado en 2017 e incluso aumentó en 2018, lo que permitió aumentar la vigilancia de los rebaños no lecheros a un intervalo casi anual.
Desde 2018, las pruebas aleatorias de los rebaños no lecheros se toman principalmente durante la inspección de la carne en los mataderos. Las dos grandes diferencias en comparación con el muestreo en rebaños lecheros mediante la clásica prueban al azar es que
- El muestreo se lleva a cabo durante un período prolongado.
- No se puede tomar una segunda muestra de los animales analizados.
2019: ¿El final del juego?
Como resultado de estos esfuerzos de vigilancia constantemente elevados, el número de casos ha vuelto a descender de 258 infecciones en 2017 a 121 en 2020. La experiencia adquirida en los últimos años demostró claramente que la disminución temprana de la vigilancia y las lagunas en las investigaciones de casos ponen en grave peligro el éxito del plan de erradicación. En cuanto a lo primero, la vigilancia de los rebaños lecheros continuó con dos muestreos al año, mientras que el seguimiento de los rebaños no lecheros se incrementó considerablemente. Esto se logró mediante la programación de una aplicación para teléfonos móviles (RiBeS-App) para identificar a los bovinos que debían ser objeto de muestreo en un matadero, lo que permite la recogida de muestras de sangre en casi todos los mataderos del país, incluidas las instalaciones más pequeñas. Ello condujo a un notable aumento del porcentaje medio de rebaños no lecheros sometidos anualmente a pruebas al azar. En general, el número de pruebas serológicas realizadas dentro del esquema de vigilancia se ha duplicado a 65.000 de 2016 a 2018. En caso de que se identifique un nuevo animal PI, se requiere un rastreo de contactos detallado y oportuno, investigando todas las posibles exposiciones retro y prospectivamente. Así, es necesario considerar la posibilidad de que la misma fuente de infección haya generado "lateralmente" animales PI adicionales al detectado por la vigilancia, así como la posibilidad de que el animal PI recién identificado ya haya dado lugar a la infección de otros animales gestantes. Las medidas para los rebaños con animales positivos siguieron siendo prácticamente las mismas durante el programa de erradicación, pero se intensificaron claramente las investigaciones de los casos sospechosos, por ejemplo, si una prueba aleatoria daba positivo pero no se podía detectar ningún animal con PI. Con la ayuda del rastreo epidemiológico informatizado y las pruebas selectivas, los animales PI se detectaron regularmente antes de lo que habría sido el caso con el sistema de vigilancia serológica. Esto también es evidente por el número de pruebas virológicas realizadas durante estas medidas de control que aumentaron 3 veces de 2016 a 2018 a 30,000 análisis por año. Esto permitió a las autoridades veterinarias estabilizar la situación, y los recuentos de casos están disminuyendo desde 2017.
Resumen y perspectivas
En esta revisión, hemos descrito el plan suizo de erradicación del BVD y los obstáculos que se encontraron y que aún persisten durante la aplicación del programa. El principal reto consiste en identificar rápidamente la fuente de infección en caso de resultado positivo durante la vigilancia de anticuerpos, y en proteger eficazmente a la población bovina de la reinfección. Se supuso que se necesitarían unos 10 años para completar la erradicación, Sin embargo, esta suposición era obviamente demasiado optimista, ya que especialmente las etapas finales parecen ser el punto crucial del programa de erradicación, y los costos actuales del programa son más altos que los proyectados anteriormente. En los últimos siete años, más del 98,5% de las granjas ya estaban libres de BVD, con un máximo del 99,8% a finales de 2014, pero identificar y eliminar los últimos animales PI es el mayor obstáculo. La vigilancia serológica generalmente permite identificar grupos de infección, pero el tiempo hasta que finalmente se identifica y elimina la fuente de infección es probablemente demasiado lento. El enfoque de rastrear todos los contactos de animales PI para identificar y probar a los animales en riesgo de infección resultó no ser lo suficientemente eficaz como para reemplazar la vigilancia de la población completa en busca de virus por una vigilancia parcial mediante pruebas de anticuerpos. Sin embargo, una alta proporción de animales PI fueron identificados muy rápidamente mediante el rastreo de contactos, lo que indica que un rastreo de contactos riguroso es extremadamente útil para reducir el riesgo de infección. Ahora debería realizarse un último esfuerzo para erradicar el virus de las pocas granjas que quedan aplicando un régimen bastante estricto. Esto podría ser desfavorable para las pocas granjas afectadas, pero sería de gran beneficio para el resto del país, ya que algunos de estos rebaños tienen ciclos de infección continuos durante varios años y representan regularmente un riesgo de infección para todos sus contactos.
Para lograr finalmente la erradicación de la BVD en Suiza, son importantes los siguientes factores y medidas para que el programa tenga éxito; la mayoría de ellos ya están en vigor:
- Completar consistentemente la base de datos de movimientos de animales por parte de cada usuario sin lagunas, posiblemente aplicando consecuencias más severas en caso de entradas fraudulentas.
- Continuación de la estricta aplicación de medidas de bioseguridad en el comercio de ganado y pastoreo de verano.
- Procedimiento estandarizado a nivel nacional tras resultados positivos en la vigilancia de anticuerpos para lograr una respuesta más rápida a través de las fronteras cantonales.
- Acortar el intervalo de tiempo entre la vigilancia activa en las “granjas de interés”, es decir, las pocas granjas que albergan repetidamente animales PI en los últimos años.
- Separación de bovinos y ovinos. Cuando esto no sea factible, debería preverse el saneamiento voluntario de la población de ovejas en cuestión para evitar costosas investigaciones una y otra vez.
Las medidas antes mencionadas deberían permitir identificar lo más rápido posible cualquier fuente de infección restante y reducir el riesgo de una mayor transmisión del virus a animales preñados sin tratamiento previo durante este intervalo de tiempo. Podría ser necesario un último esfuerzo más riguroso durante un tiempo bastante corto para lograr el objetivo final de erradicar el BVDV de la población bovina en Suiza. Sin embargo, incluso después de completar con éxito esta tarea, es necesario implementar una vigilancia continua ya que los pestivirus de rumiantes podrían reintroducirse en la población de ganado altamente susceptible, por ejemplo, mediante la importación de animales o semen o vacunas contaminadas, y como Los pestivirus siguen siendo endémicos en los pequeños rumiantes de Suiza, principalmente en las ovejas, y plantean un riesgo constante de reintroducción. Este esquema de vigilancia también será una necesidad para que las regulaciones federales y europeas informen continuamente sobre la ausencia de enfermedades, lo que se espera que pronto se logre. Como consecuencia de estas medidas, pronto se logrará la erradicación completa, y el paso final será entonces la documentación continua de la ausencia de la enfermedad.
En los laboratorios de diagnóstico veterinario de AsturBiotech disponemos de las instalaciones necesarias para realizar las pruebas de BVD, a muestras de sangre, plasma, cartílago de oreja o leche para la determinación mediante prueba de ELISA de los anticuerpos y/o antígeno. Los resultados son proporcionados en 24-48 horas para que el profesional veterinario o el ganadero disponga rápidamente de la información diagnóstica necesaria para tomar las medidas terapéuticas y/o de prevención indicadas para el tratamiento de esta patología bovina.
Referencias
- Schweizer M, Stalder H, Haslebacher A, Grisiger M, Schwermer H, Di Labio E. Eradication of Bovine Viral Diarrhoea (BVD) in Cattle in Switzerland: Lessons Taught by the Complex Biology of the Virus. Front Vet Sci. 2021 Sep 7;8:702730. doi: 10.3389/fvets.2021.702730. PMID: 34557540; PMCID: PMC8452978.









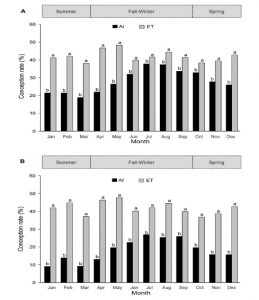 (Figura 1). Tasa de concepción con IA o TE de vacas Holstein a lo largo del año.(A) vacas no repetidoras. (B) vacas repetidoras.
(Figura 1). Tasa de concepción con IA o TE de vacas Holstein a lo largo del año.(A) vacas no repetidoras. (B) vacas repetidoras.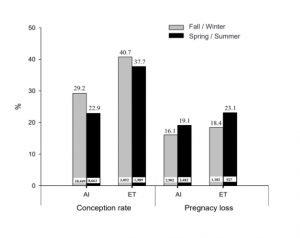 (Figura 2). Tasa de concepción y pérdida embrionaria con IA o ET durante épocas de otoño/invierno y primavera/verano
(Figura 2). Tasa de concepción y pérdida embrionaria con IA o ET durante épocas de otoño/invierno y primavera/verano